Alkohol und Wasser
Whisky und Wasser
Whisky besteht vorwiegend aus Wasser und Alkohol. Der Rest (<1%) im Whisky sind Geschmacksstoffe und Aromen. Sprechen wir von Alkohol, so meinen wir im Nahrungsmittelumfeld ausschließlich den Ethylalkohol, der auch abgekürzt mit Ethanol bezeichnet wird. Die chemische Formel lautet C2H5OH.
Bei der Whiskyproduktion wird besonders darauf geachtet, dass kein Methylalkohol (Methanol, CH3OH) im Fertigprodukt enthalten ist. Die verwendeten Hefen sind so gezüchtet, dass sie kein Methanol erzeugen. Die Abtrennung des Vorlaufs bei der Destillation sorgt für eine doppelte Sicherheit.
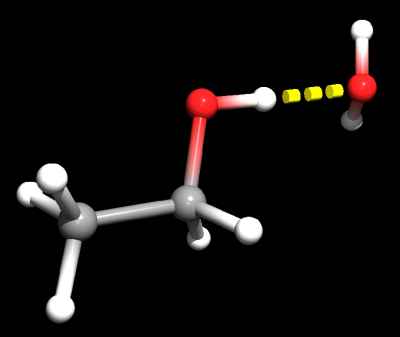
Das linke Molekül in der rechten Grafik stellt das Ethanol-Molekül dar. Die grauen Atome sind die Kohlenstoffatome (C), das rote Atom ist der Sauerstoff (O) und die weißgrauen Atome stellen den Wasserstoff (H) dar. Rechts vom Ethanol-Molekül ist ein Wasser-Molekül (H2O) angeordnet.
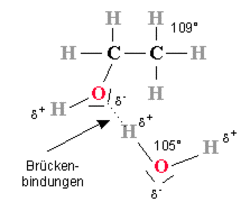
Betrachtet man das Ethanol-Molekül genauer, so stellt man fest, dass das Molekül bis auf das Sauerstoffatom symmetrisch zu einer senkrechten Ebene zwischen den Kohlenstoffatomen ist. Lediglich ein Wasserstoffatom ist durch eine Sauerstoff/Wasserstoffgruppe (eine sogenannte OH-Gruppe) ersetzt. Diese OH-Gruppe führt nun dazu, dass das in Summe elektrisch neutrale Ethanol-Molekül lokale Elektronegativitätsunterschiede (sogenannte Dipole d+, d-) aufweist. Normale Wasser-Moleküle zeigen auch diese Dipole, da sie ebenfalls abgewinkelt angeordnet sind (Winkel 109°). Diese Dipole auf Ethanol- und Wasserseite sorgen nun dafür, dass sich Wasserstoffbrückenbindungen zwischen den Molekülen bilden.
Aus diesem Grund ist die OH-Gruppe hydrophil (wasserliebend). Der Rest des Ethanols, die C2H5-Gruppe, ist lipophil (fettliebend). Natürlich ist die Ausbildung der Wasserstoffbrückenbindungen umfassend, sodass sich an sämtlichen Dipolen in der oberen Zeichnung ebenfalls Dipole mit umgekehrten Vorzeichen anlagern. Dies können im Einzelfall Dipole von Wasser- oder Alkohol-Molekülen sein.
Whisky und Wasser - Hintergrundwissen
Trinken Sie Ihren Whisky immer pur oder verdünnen Sie mit Wasser? Falls Sie zu der zweiten Gruppe gehören, gibt es in diesem Video Hintergrundwissen in Physik und Chemie. In einem anderen Video geht es dann, um das geschmackliche Erlebnis.
Fragen und Antworten
Warum wird hochprozentiger Whisky warm, wenn man ihn mit Wasser verdünnt?
Die OH-Gruppen des Ethanols bilden Wasserstoffbrückenbindungen zu den Wassermolekülen aus und dabei entsteht eine Mischungswärme, die das Gemisch spürbar erwärmt.
Warum trüben sich manche Whiskys ein, wenn man sie mit Wasser verdünnt?
Im Whisky sind ethanollösliche Bestandteile enthalten, die in Wasser jedoch schlecht löslich sind. Erhöht man nun den Wasseranteil, so dauert es eine gewisse Zeit, bis sich diese Bestandteile wieder an den Alkohol anlagern (lipophil) und der Whisky wieder klar wird.
Warum werden einzelne Whiskys vor dem Filtern abgekühlt?
Die meisten chemischen Stoffe sind bei höherer Temperatur besser löslich als bei tieferer. Die Trübstoffe kommen während der Lagerung aus der Fasswand in den Whisky. Kühlt man den Whisky nun ab, so fallen diese Trübstoffe aus und können durch einen Filter besser aufgenommen werden.
Warum bilden sich Schlieren, wenn man Whisky mit Wasser mischt?
Dies ist kein chemischer sondern vielmehr ein physikalischer Effekt. Der Dichteunterschied von Wasser und Alkohol, einhergehend mit unterschiedlichen Brechungsindices führt zur Schlierenbildung. Haben sich Wasser und Alkohol richtig durchmischt, so sieht man auch keine Schlieren mehr.
Warum kann man durch Destillation (Brennen) kein 100%-iges Ethanol erzeugen?
Ethanol und Wasser bilden ein Azeotrop (96% Ethanol, 4% Wasser), dessen Siedepunkt unter dem Siedepunkt von reinem Ethanol liegt (78.15°C bei 1 bar (760mm) und 95.6% Alkoholgehalt (Gewicht)). Beim Sieden eines Ethanol-Wasser Azeotrops kann deshalb nie der Siedepunkt von 100%-igem Ethanol erreicht werden, da vorher die 96/4 Mischung siedet. Mit der Zugabe von Benzol (Achtung giftig), kann man 100%-iges Ethanol erzeugen, da das Benzol ein Azeotrop mit dem Wasser bildet und so das Wasser transportieren kann. Gesünder geht das heutzutage mit Molekularsieben, mit denen man nahezu 100%-iges Ethanol herstellen kann.
Einige physikalisch Daten
| Alkohol- konzentration | Dichte (20°C, kg/l) | Brechungsindex zu Luft (20°C, Natriumlicht) | Relative Viskosität zu Wasser (20°C) |
|---|---|---|---|
| 0% 1) | 0.9982 | 1.3333 | 1.000 |
| 10% | 0.9819 | 1.3395 | 1.498 |
| 20% | 0.9687 | 1.3469 | 2.138 |
| 30% | 0.9539 | 1.3535 | 2.662 |
| 40% | 0.9352 | 1.3583 | 2.840 |
| 46% | 0.9227 | 1.3604 | 2.837 |
| 50% | 0.9139 | 1.3616 | 2.807 |
| 60% | 0.8911 | 1.3638 | 2.542 |
| 70% | 0.8676 | 1.3652 | 2.210 |
| 80% | 0.8436 | 1.3658 | 1.877 |
| 90% | 0.8180 | 1.3650 | 1.539 |
| 100% 2) | 0.7893 | 1.3614 | 1.201 |
1) Reines Wasser
2) Reiner Alkohol
Falls Sie Ergänzungen bzw. Anmerkungen zu diesem Text haben, so schicken Sie mir bitte eine ![]() Mail.
Mail.